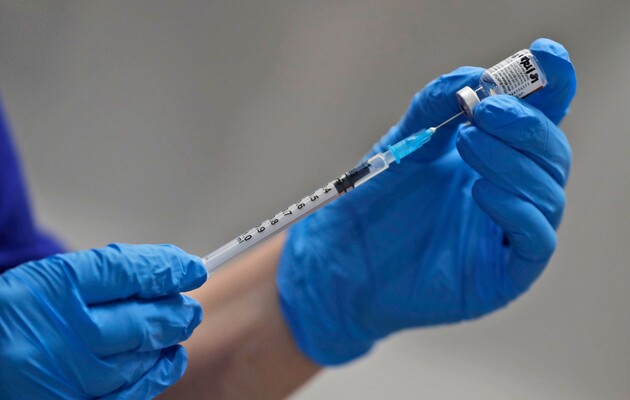
Управление по санитарному надзору США (FDA) опубликовало заключение о наличии всех надлежащих данных, необходимых для экстренного применения вакцины от коронавируса COVID-19 американской компании Pfizer и немецкой BioNTech.
Об этом сообщается на сайте организации.
"Данные о безопасности, эффективности и иммуногенности в заявке на экстренное применение обеспечивают положительную оценку рисков и пользы вакцины от COVID-19 компаний Pfizer и BioNTech, а также соответствуют требованиям к данным, указанным в руководстве FDA на экстренное применение", - говорится в документе.
"FDA установили, что производитель предоставил надлежащую информацию, гарантирующую качество вакцины... для получения разрешения на продукт в рамках экстренного применения", - отмечается в документе.
Также в FDA отметили, что представленные компаниями данные демонстрируют, что вакцина предоставляет существенную защиту уже после первой дозы - вакцина компании Pfizer требует введения двух доз с интервалом в три недели.
На четверг запланировано проведение собрание Комитета FDA по вакцинам для рассмотрения экстренного использования вакцины Pfizer и BioNTech.
Ранее сообщалось, что США до конца 2020 года должны получить вакцину против коронавируса для 20 млн граждан страны, рассказал адмирал Бретт Джируар, ответственный в Белом доме за программу тестирования на COVID-19. Страны Европейского Союза смогут получить первые вакцины от COVID-19 через три-четыре недели
Всего в США с начала пандемии выявлено более 13,6 млн случаев заражения коронавирусом, более 272 тыс. пациентов скончались, а свыше 8 млн человек выздоровели. Число госпитализаций в стране побило рекорд, превысив 91 тыс. человек, причем более 18 тыс. американцев находятся в палатах интенсивной терапии.
Также ранее стало известно, что вакцинация в Украине будет проходить в три этапа.
Первый этап вакцинации, по его словам, будет проводиться, когда Украина получит вакцину в количестве не более 10% от населения страны.


















 Войти с помощью Google
Войти с помощью Google